Мы обследовали 67 пациентов обоего пола: группу сравнения составили 45 больных ХОБЛ, группу контроля – 25 практически здоровых добровольца. В исследуемой группе были пациенты с ХОБЛ I–IV-й стадии: 19 мужчин, 23 женщины (средний возраст 60,0±2,74 года). Группа контроля представлена 25 практически здоровыми добровольцами: 9 мужчин, 16 женщин (средний возраст 47,60±3,46 года). Всем обследуемым подробно разъяснены цели и задачи исследования, на заданные вопросы даны исчерпывающие ответы, затем стороны подписали информированное согласие. Исследование проспективное, нерандомизированное; тип дизайна – сравнение результатов в параллельных группах. Исследование проводилось на базе ГБУ РО «ОКБ
им. Н.А. Семашко» и ГБУ РО «ГКБ №5» Рязани. Протокол исследования одобрен локально-этическим комитетом ФГБОУ ВО РязГМУ на заседании №4 от 09.12.2009. В исследование не включались пациенты при выявлении следующих критериев: первичная легочная гипертензия (ЛГ), сердечная недостаточность, стеноз коронарной артерии ≥50%, легочное сердце, первичная болезнь почек или печени, пороки сердца, кардиомиопатия, перикардит, тромбоз глубоких вен, декомпенсация сопутствующих хронических заболеваний, серьезная органическая патология сердечно-сосудистой системы, заболевания соединительной ткани, наличие ВИЧ-инфекции.
Для определения параметров одышки мы применяли модифицированный опросник mMRC, шкалу субъективной оценки физической нагрузки Борга. Для оценки сопутствующих жалоб использовали визуально-аналоговую шкалу (ВАШ). ТФН оценивали с помощью 6МШТ с дальнейшим определением тяжести одышки по шкалам mMRC и Борга [30].
Определение и оценка параметров внешнего дыхания выполнялись согласно стандартам Американского торакального общества и Европейского респираторного общества [30], а также рекомендациям Российского респираторного общества [31]. Спирография проведена на спирографе СМП-21/01-Р-Д; капнограмма в покое регистрировалась с помощью капнографа «Еламед КП-01» компании «Еламед». Параметры гемодинамики, размеры сердца и сосудов определялись с помощью допплерэхокардиографии сердца на аппарате EnVisor CHD компании Philips с применением стандартных доступов согласно рекомендациям [30].
После проведения всех перечисленных обследований пациентам выполнены динамическая капнография и пульсоксиметрия на капнографе-пульсоксиметре LifeSense LS1-9R (MedAir AB) во время проведения 6МШТ. У пациентов регистрировали тренд показателей парциального давления CO2 в выдыхаемой воздушной смеси (ETCO2), насыщения крови кислородом (SpO2), частоты сердечных сокращений (ЧСС), частоты дыхательных движений (ЧДД) до, во время и после проведения 6МШТ, который проводили в соответствии с Клиническими рекомендациями Американского торакального общества (2014 г.) [14]. Оценивалась динамика жалоб пациента после проведенной физической нагрузки, а также причины остановки во время ходьбы.
После проведенного обследования делался анализ ТФН и проводимой терапии. Далее пациенты наблюдались в течение 68 мес. Регистрировались число обострений ХОБЛ в течение года, а также фатальные события. Статистическая обработка полученных результатов осуществлялась с помощью лицензионного пакета прикладных статистических программ Excel 2016 (Microsoft Corporation, США) и пакета прикладных программ SPSS 22 (SPSS: An IBM Company, США). В случае, когда распределение признаков в группах соответствовало нормальному закону распределения, для сравнения групповых средних мы использовали параметрический критерий Стьюдента, в противном случае сравнительный анализ групп проводился с помощью непараметрических методов. С целью определения соответствия переменной нормальному распределению применялся критерий Колмогорова–Смирнова. Если нулевая гипотеза об отсутствии различий отклонялась, проводилось парное сравнение групп с использованием непараметрического теста Манна–Уитни. Результаты представлены в виде среднего значения ± стандартное отклонение. Для определения предикторов летальности рассчитывалась модель пропорциональных рисков (Cox regression). Для оценки выживаемости в зависимости от признака использовался анализ Каплана–Мейера. Различия считались статистически значимыми при p<0,05. Зависимость количественных показателей мы оценивали с помощью корреляционного анализа.
Результаты и обсуждение
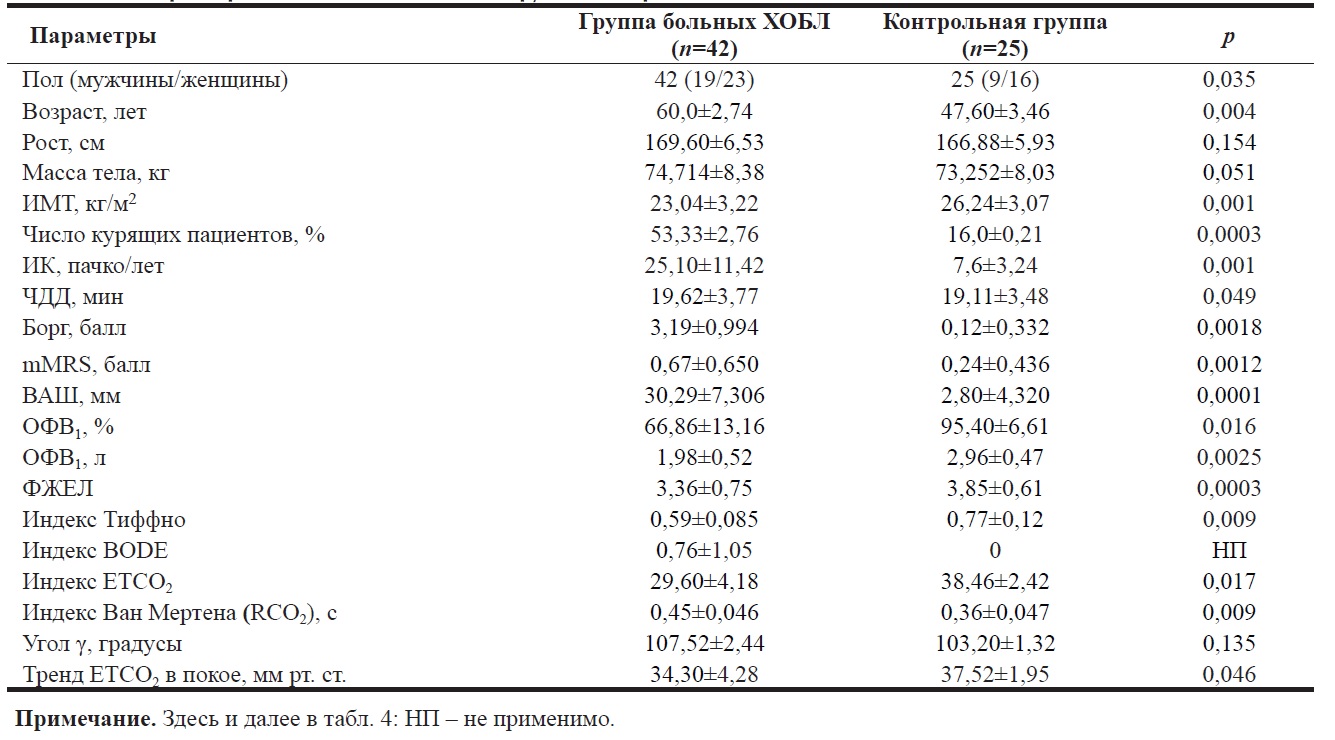
В группе пациентов с ХОБЛ мужчины составили 45,2%, женщины – 54,8%, средний возраст – 60,0±2,74 года, ИМТ составил 23,04±3,22 кг/м2. Количество курящих пациентов 53,33±2,76%, индекс курения (ИК) – 25,10±11,42 пачко/лет (табл. 1).
Группа контроля представлена 36% мужчин, 64% женщин, средний возраст 47,60±3,46 года, ИМТ составил 26,24±3,07 кг/м2. Число курящих пациентов 16,0±0,21%, ИК – 7,6±3,24 пачко/лет. При сравнении показателей выявлено, что ИМТ в группе сравнения достоверно ниже, чем в группе контроля (р=0,001), число курящих пациентов в группе сравнения и ИК достоверно выше (р=0,0003 и р=0,001 соответственно). При анализе параметров одышки в покое выявлено, что все показатели выше в группе пациентов с ХОБЛ. Уровень одышки по шкале ВАШ составил 30,29±7,31 мм против 2,80±4,32 мм в группе контроля (р=0,0001), по шкале mMRS – 0,67±0,65 балла против 0,24±0,43 балла (р=0,0012), по шкале Борга – 3,19±0,99 балла против 0,12±0,33 балла (р=0,0018).
При оценке показателей спирометрии выявлено, что в группе сравнения все показатели достоверно ниже, чем в группе контроля (р<0,05). Так, объем форсированного выдоха за 1-ю секунду (ОФВ1) в группе ХОБЛ составил 66,86±13,16%, в группе контроля – 95,40±6,61% (р=0,016), форсированная жизненная емкость легких (ФЖЕЛ) в группе сравнения составила 3,36±0,75, в группе контроля – 3,85±0,61 (р=0,0003), индекс Тиффно в группе пациентов с ХОБЛ составил 0,59±0,085, в группе контроля – 0,77±0,12
(р=0,009).
В результате ретроспективного анализа ECLIPSE показано, что большинство больных ХОБЛ включаются в категории с высоким риском обострения вследствие снижения легочной функции По данным исследований, снижение ОФВ1<50% в большинстве случаев играет решающую роль при отнесении больных ХОБЛ к категории высокого риска развития частых обострений [32].
При анализе показателей капнограммы в покое выявлено, что индекс ЕТСО2 (tgα/tgβ) в группе ХОБЛ составил 29,60±4,18, что ниже индекса ЕТСО2 группы контроля, однако выше, чем при бронхообструкции. В группе контроля индекс ЕТСО2 в норме и равен 38,46±2,42. Индекс Ван Мертена (показатель бронхообструкции) в группе ХОБЛ выше, чем в группе контроля, и составил 0,45±0,046 с (р˂0,01), однако этот показатель все же ниже, чем при бронхообструкии (˃0,5 с). Угол γ в группе ХОБЛ выше нормы и выше, чем в группе контроля, и составил 107,52±2,44º.
Показатели капнограммы отражают тенденцию к развитию вентиляционно-перфузионных рассогласований. В работе З.В. Воробьевой (2005 г.) [33] выявлены изменения капнограммы в виде увеличения объема мертвого пространства у больных ХОБЛ в начальной стадии при отсутствии еще спирометрических признаков бронхиальной обструкции. Предположено, что при ХОБЛ поражение органов дыхания начинается с респираторной зоны легких.
Поэтому ранняя диагностика респираторных нарушений, в том числе у курильщиков, по мере развития и прогрессирования у них ХОБЛ, задолго до появления признаков бронхиальной обструкции и клинических проявлений, возможна с помощью капнометрии.
Дистанция 6МШТ (табл. 2) у пациентов колебалась в широком диапазоне – от 90,75 до 707,25 м – и составила в среднем 509,05 [351,25; 536,50]. Широкий разброс дистанции имел место и внутри каждой стадии ХОБЛ. Значимых различий между средними величинами расстояния 6МШТ у больных ХОБЛ различных стадий не оказалось (р>0,05).
Мы оценили расстояние, пройденное нашими пациентами за 6 мин, в процентах от должной оптимальной величины 6МШТ, соответствующей их полу, возрасту, росту и массе тела, которая вычислялась по формулам, предложенным P. Enright и соавт. [34].
Мы выяснили, что чем тяжелее стадия, тем меньший процент пациентов прошел должное расстояние 6МШТ. 6МШТ у больных ХОБЛ позволяет более точно оценить тяжесть заболевания и прогноз течения, чем ОФВ1. Риск летального исхода при ХОБЛсоставил 0,82 на каждые 50 м увеличения расстояния, пройденного за 6 мин, а снижениеданного показателя ниже 289 м повышало риск летального исхода в 2 раза [35]. Уменьшение дистанции 6МШТ у больных ХОБЛ обратно пропорционально снижению ОФВ1: в исследовании C. Casanova и соавт. ОФВ1 на II стадии заболевания снижался на 40 мл в год, на III стадии – на 10 мл в год и на IV стадии практически переставал изменяться, тогда как расстояние 6МШТ на II стадии ХОБЛ уменьшалось на 2%, на III стадии – на 19%, а на IV стадии – на 26% от исходного [6].
При проведении 6МШТ рекомендуется регистрировать ЧСС до и после нагрузки. Показатель ЧСС вносит свой вклад в результат 6МШТ. При выполнении 6МШТ можно также оценивать максимальную ЧСС и восстановление (снижение) ЧСС через 1 или 2 мин после окончания теста. Так, у больных с идиопатическим легочным фиброзом пороговое значение снижения ЧСС через 1 мин после завершения 6МШТ (ЧСС1), достоверно прогнозирующее летальность, составляет ≤13 в минуту. У больных с легочной артериальной гипертензией снижение ЧСС на <16 в минуту связано с риском клинического ухудшения [36]. Одышку как причину остановки/замедления темпа во время выполнения 6МШТ отмечали достоверно чаще обследуемые из обеих групп (92,85±0,26 и 48,0±5,1%; р=0,087). Также во время выполнения физической нагрузки пациенты отмечали: слабость в ногах (54,76±0,51% в группе сравнения и 40,0±5,0% в группе контроля; р=0,0018), сердцебиение (28,57±0,45% в группе ХОБЛ и 0,0±4,08% в контрольной группе; р=0,0074).
Таблица 1. Характеристики больных ХОБЛ и группы контроля
Также усилились показатели одышки во время выполнения 6МШТ, причем в группе сравнения достоверно выше, чем в группе контроля (р<0,05). Уровень одышки по шкале ВАШ составил 58,83±8,12 мм против 27,6±7,13 мм в группе контроля (р=0,0053), по шкале mMRS – 1,62±0,66 балла против 0,8±0,41 балла (р=0,0089), по шкале Борга – 5,48±0,86 балла против 3,24±0,78 балла (р=0,0017).
В проведенных многочисленных исследованиях выраженность одышки по результатам mMRС, шкалы Борга, снижение ТФН (по результатам функциональных нагрузочных проб) являются признаками, указывающими на наличие или усиление ЛГ у пациентов с ХОБЛ.
По данным литературы, частота выявления ЛГ у пациентов с умеренной и тяжелой ХОБЛ колеблется от 25 до 50% [37], при этом есть мнение, что распространенность ЛГ при ХОБЛ составляет примерно 5–40% [9], а частота выявления ЛГ находится в прямой зависимости от степени тяжести ХОБЛ. В нашем исследовании число пациентов с ХОБЛ с признаками ЛГ составило 30,95% (n=13). ЛГ у больных ХОБЛ ухудшает переносимость физической нагрузки и является предиктором госпитализации и смертности [9, 37]. При наличии ЛГ у больных ХОБЛ ухудшается газообмен, усиливается одышка, развивается дисфункция правого желудочка и появляются периферические отеки [38]. Сокращение площади капиллярного русла у больных ХОБЛ с тяжелой
ЛГ заметно ограничивает их физическую активность [9].
При анализе тренда ЕТСО2 в покое выявлена следующая картина. Параметры дыхания во время выполнения 6МШТ представлены в табл. 2. При выполнении 6МШТ и регистрации тренда ЕТСО2 выявлено повышение данного показателя во время выполнения нагрузки во всех обследуемых группах (см. табл. 2, 3).
В группе ХОБЛ на нагрузку отмечался нормокапнический тип вентиляции, и показатель тренда ЕТСО2 составил 39,90±2,68 мм рт. ст. В группе контроля также отмечался нормокапнический тип вентиляции во время нагрузки, однако уровень тренда ЕТСО2 ниже и составил 36,07±5,04 мм рт. ст. При этом при сравнении показателей ЕТСО2 в покое и при нагрузке выявлена прямая пропорциональная зависимость. Также при выполнении нагрузки у пациентов обследуемых групп наблюдалось увеличение ЧДД: в группе больных ХОБЛ – до 24,73±5,57/мин, в контрольной – до 23,36±4,43/мин. При анализе тренда ЧСС во время нагрузки выявлено, что данный показатель повышался в каждой группе по сравнению с аналогичным в покое, причем увеличение ЧСС в группе ХОБЛ достоверно выше, чем в группе контроля (р˂0,01).
При оценке сатурации в обследуемых группах во время 6МШТ выявлено следующее: в группе ХОБЛ среднее значение SpO2 составило 94,92±1,68%, что достоверно ниже, чем в группе контроля. Десатурация (ΔSpO2) кислородом в течение 6МШТ у пациентов с ХОБЛ является предиктором важных клинических исходов, таких как смертность, обострение основного заболевания, снижение функции легких и потеря мышечной массы тела [39, 40]. После проведения большого количества исследований и долгих дискуссий, а также после исследований С. Casanova и соавт. [6] десатурация рассмотрена как снижение SpO2>4% от начального уровня или падение <90% во время выполнения физической нагрузки. У пациентов с ХОБЛ показано, что десатурация
во время физической нагрузки в первую очередь является следствием недостаточного увеличения вентиляции вследствие гиперинфляции [39, 41]. Тем не менее может быть, что нагрузочная десатурация сама по себе вредна. Постоянная гипоксемия связана с развитием неблагоприятных последствий у пациентов с ХОБЛ, таких как ЛГ, вторичная полицитемия, дисфункция скелетных мышц, системное воспаление и нейрокогнитивная дисфункция [39, 41, 42].
Можно предположить, что периодическая десатурация, возникающая при выполнении упражнений у пациента, может привести к тем же долговременным эффектам, что и постоянная гипоксемия, из-за возможной повторной микротравмы, вызванной десатурацией, как установлено в исследовании А. Scott и соавт. [43], что приводит к хронической травме.
Таблица 2. Показатели расстояния, пройденного за 6 мин, причины остановки пациентов во время ходьбы
Таблица 3. Показатели динамической капнографии и пульсоксиметрии во время выполнения 6МШТ

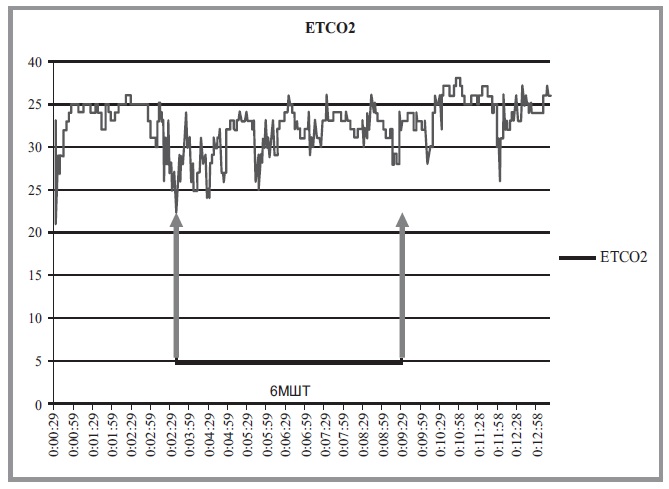
При анализе графиков трендов ЕТСО2 выявлено волнообразное повышение показателей во время выполнения нагрузочного теста – так называемое периодическое дыхание (ПД; periodic breathing) [29]. Пример данных «колебаний» при анализе трендов ЕТСО2 представлен на рис. 1.
Прогностической ценностью обладают также колебания показателей, измеренных во времени. При проведении метаанализа пациентов с ХСН у 36,64% выявлено EOV во время проведения нагрузочных тестов [13]. Так, у пациентов с хронической сердечной недостаточностью с EOV риск фатальных событий возрастал по сравнению с пациентами без EOV в 4 раза [29].
Таким образом, нами проанализированы все графики показателей динамической капнографии и пульсоксиметрии, выполненных с помощью капнографа-пульсоксиметра LifeSience. В группе больных ХОБЛ признаки ПД тренда ЕТСО2 встречались достоверно чаще (у 80,95%), чем в группе контроля (р˂0,05; табл. 4).
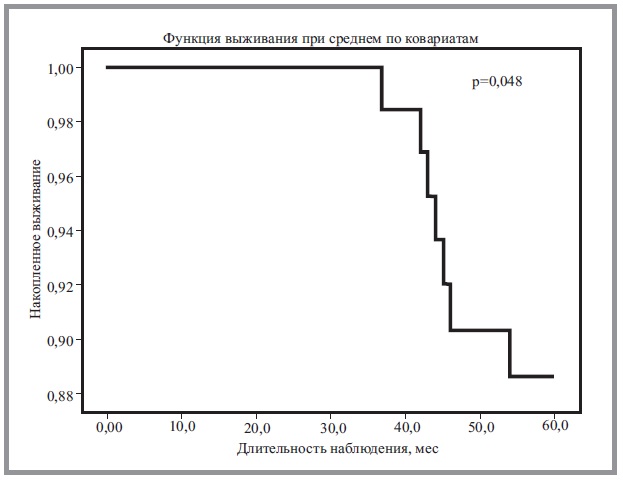
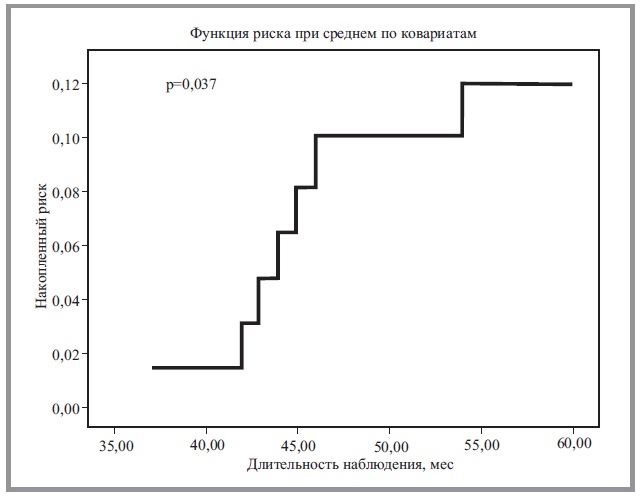
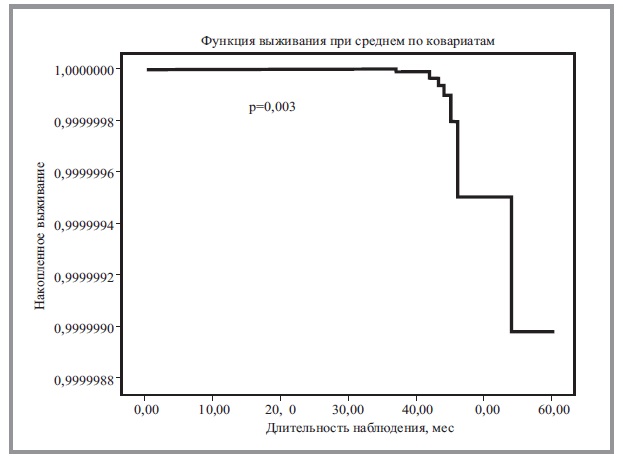
Анализ выживаемости проведен на основании динамического наблюдения за пациентами в течение 5 лет (60 мес, 1825 дней). Во время динамического наблюдения регистрировались количество обострений в год, а также наступление/отсутствие фатального события. Выживаемость пациентов и риск смерти оценены при помощи регрессионного анализа пропорциональных рисков Кокса (рис. 2, 3).
Предикторы летальности при ХОБЛ проанализированы во многих исследованиях [1, 9, 35, 37, 44, 45]. Независимыми предикторами смерти при ХОБЛ являются возраст, показатели легочной функции (ОФВ1/ФЖЕЛ), одышка, сопутствующие заболевания, ИМТ (<23,0 кг/м2), ТФН, индекс BODE (ИМТ, степень обструкции дыхательных путей, одышка и переносимость физической нагрузки), ограничение воздушного потока, а также количество предыдущих госпитализаций [2, 3, 6, 35, 44].
При анализе группы больных ХОБЛ выявлено, что число умерших пациентов через 5 лет (60 мес) составило 16,67%. У всех пациентов наблюдались признаки ПД при анализе тренда ЕТСО2 динамической капнографии (см. рис. 1). Также проанализировано количество обострений/ухудшений ХОБЛ в группе сравнения (табл. 5). В среднем число обострений/ухудшений ХОБЛ составило 1,19±0,13 в год. Увеличение данного показателя наблюдалось к 3-му году наблюдения и составило 1,26±0,15. Выявлена слабая корреляционная зависимость количества обострений/ухудшений основного заболевания в группе сравнения от наличия/отсутствия признаков ПД во время физической нагрузки в зависимости от длительности наблюдения (р>0,05).
С помощью регрессионного анализа пропорциональных рисков Кокса летальности больных ХОБЛ выявлено прогностическое значение комплексной оценки следующих параметров пациента: ИМТ, индекса BODE, показателя одышки по шкалам mMRS, Борга, ОФВ1, индекса Тиффно, признаков ЛГ, расстояния 6МШТ, признаков ПД и десатурации во время 6МШТ (рис. 4). При этом оценивался общий вклад данных показателей в риск развития летального события (р=0,003). Наибольшее влияние в данной модели оказали следующие параметры: значение показателя mMRS (Вальд 1,034, р=0,039), индекс BODE (Вальд 3,004, р=0,008), показатель ОФВ1 (Вальд 3,524, р=0,0061), десатурация (Вальд 2,094, р=0,024), ЛГ (Вальд 3,067, p=0,039), а также наличие ПД во время 6МШТ (Вальд 2,674, р=0,035).
Рис. 1. Тренд ЕТСО2 у пациента с ХОБЛ во время выполнения 6МШТ