Дыхание должно происходить без зевоты,
всхлипов, кашля, одышки и чихания»

Бронхиальная астма, свистящие хрипы, флаттер. Возможные взаимоотношения
Авторы: Абросимов Владимир Николаевич, докт. мед. наук, профессор, зав. кафедрой терапии ФДПО с курсом семейной медицины ГБОУ ВПО РязГМУ Минздрава России, Рязань, Россия, 2016 г.
Резюме
Рассматриваются взаимоотношения свистящих хрипов (wheezing) и вибрации (флаттера) у больных бронхиальной астмой (БА). Приводятся экспериментальные данные о влиянии вибрации на патофизиологические изменениях верхних дыхательных путей. Высказывается предположение, что вибрация (флаттер), как один из ключевых механизмов свистящих хрипов, может способствовать развитию воспалительных изменений, эндотелиальной дисфункции микроциркуляторного русла в нижних отделах дыхательных путей у больных БА.
Ключевые слова: бронхиальная астма, свистящие хрипы, флаттер, взаимоотношения.
Relationships wheezing and vibration (flutter) in patients with asthma are considered. Experimental data on the effect of vibration on the pathophysiological changes in the upper respiratory tract are shown. It is suggested that the vibration (flutter), as one of the key mechanisms of wheezing, may contribute to the development of inflammatory changes, endothelial dysfunction of the microvasculature in the lower respiratory tract in patients with asthma.
Кey words: bronchial asthma, wheezing, vibration (flatter), relationship.
Бронхиальная астма (БА) является одним из широко распространенных заболеваний. В соответствии с современными представлениями БА это хроническое персистирующее воспалительное заболевание ведущее к структурным изменениям и ремоделированию дыхательных путей. Понятие ремоделирование включает следующие основные компоненты: гипертрофию гладких мышц, гиперплазию бокаловидных клеток, субэпителиальный (суббазальный) фиброз и ангиогенез. [1.2,3,4,5]. Развивается бронхиальная гиперреактивность [6].
Хронический воспалительный процесс, ремоделирование дыхательных путей, бронхиальная гиперреактивность, бронхиальная обструкция определяют характерную клинические симптомы БА: свистящие хрипы, кашель, диспное [7.8,9]. Причем, свистящее дыхания относится к наиболее частым. Так, по данным эпидемиологического исследования ECRHS (European Community Respiratory Health Survey) о распространенности симптомов БА среди лиц ( мужчин и женщин) 20-44 - летнего возраста приступы удушья встречаются в среднем у 9,7%, а свистящее дыхание у 32,0% [10]. В другом эпидемиологическом исследования (SAPALDIA) было установлено, что из 9651 обследованого из общей популяции, 1360 (14%) указывали на свистящие хрипы. У больных БА свистящие хрипы были самым распространенным симптомом ( 168/225; 75%) [11].
В большинстве сообщений, включая докладе рабочей группы GINA (Глобальная стратегия лечения и профилактика бронхиальной астмы, пересмотр 2015)), указывается, что свистящее дыхание (wheezing) является одним из ключевых диагностических критериев БА [12,13,14]. У больных БА был проведен анализ параметров легочных звуков в сопоставлении с данными легочных функций. Было сделано заключение, что оценка легочных звуков может успешно применятся в качестве биомаркера бронхиальной астмы [15].
Следует также отметить, что среди гетерогенных групп больных ХОБЛ предлагают выделить еще один важный клинический фенотип: ХОБЛ с наличием свистящих хрипов. Подчеркивается, что свистящие хрипы у больных ХОБЛ ассоциируются с выраженностью клинической симптоматики, более частыми обострениями и худшими функциональными показателями дыхания [16].
По существующим представлениям свистящие хрипы(wheezing) – это дополнительные хрипы музыкального характера, постоянной длительности, связанные с дыханием и слышимые на расстоянии. Подобные хрипы обычно ассоциируются с обструктивными нарушениями дыхания вследствие самых различных причин и если они содержат одинаковые частотные характеристики, то называются монофоническими (однотонными), а если несколько – полифоническими [17,18,19]. Полифонические свистящие хрипы указывают на более серьезные обструктивные нарушения [20].
В настоящее время акустико-биомеханический феномен формирования шумов анализируется с помощью современных компьютерных технологий у здоровых [21,22] и при различных заболеваниях бронхо-легочной системы [23,24,25].
Установлено, что свистящие хрипы (wheezing) это постоянные звуки высокого уровня с преобладающей частотой >100 Гц, достигающей в ряде случаев 2500 Гц. Их длительность во время экспираторной фазы больных бронхиальной астмой составляет от 80 до 250 мс.[26,27].
Патофизиологические механизмы генерации свистящих хрипов, у больных БА являются сложными и, окончательно не установленными. В настоящее время к ведущему механизму их возникновения относят флаттер (flutter) – вибрации стенок дыхательных путей при прохождении воздуха через суженные мелкие бронхи [28,29] а так же срыв вихрей на бифуркации бронхиального дерева [30].
Рассматривая генерацию звука в легких указывают, что основной механизм флаттера дыхательных путей в упрощенном виде описывается уравнением Бернулли: если в результате возмущения бронх сужается, то в этом месте снижается давление протекающего газа и возрастают силы, направленные на дальнейшее сужение бронха. Упругость и изгибная жесткость бронхов этому препятствуют. Демпфирование стенок бронхов и вязкость газа приводят к сдвигу фаз между деформациями бронха и колебаниями давления газа. Это вызывает автоколебания давления газа и деформации стенок [31].
Для объяснения появления свистящих хрипов наиболее принятой остается теория гидродинамического флаттера (N. Gavriely et al. (1984). Были указаны 5 возможных механизмов 1) резонанс стенок дыхательных путей, вследствие турбулентности, 2) резонатор Гельмгольца, индуцированной турбулентностью, 3) акустическая стимуляция вихревого звука, 4) завихрения индуцируемые стенкой резонатора и, 5) динамический флаттер. Авторы отдают предпочтение 4 и 5-й моделям, которые согласуются с экспериментальными наблюдениями лучше, чем предложенные ранее механизмы.
Следует также отметить, что во время респираторного цикла генерируется энергия, которую определяют современные неинвазивные технологии исследования легочных звуков у здоровых и больных различными заболеваниями органов дыхания [33,34,35]. Региональная энергия и визуальный имидж легочных звуков изучаются с помощью устройств типа VRIxp System (Deep Breeze, Ltd., Or-Akiva, Israel). Количественные характеристики (Vibration response imaging, VRI) включают показатели распределение вибрационной энергии (vibration energy distribution (%) и амплитуда энергии вибрации (vibration energy amplitude, AU) [36,37].
Различные эффекты вибрационного воздействия активно изучаются у больных с храпом и синдромом сонного апное. Известно, что храп является результатом вибрации мягких тканей глотки. При моделировании храпа было установлено, что вибрация индуцирует воспалительный каскад в клетках эпителия дыхательных путей. Чрезвычайно интересные данные представили Puig F. с соавт. ( 2005), которых показали, что вибрационные стимулы усиливают синтез интерлейкина-8 ( IL-8) клеточной модели храпа. Эффект вибрации оценивали путем сравнения пролиферации клеток и высвобождение интерлейкина-8 (IL-8; иммуноферментный анализ) в клетках, подвергнутых вибрационной стимуляции по сравнению с контролем. Концентрация IL-8 в надосадочной жидкости была значительно увеличена после 12 часов и 24 часов вибрации. Экспериментальное исследование по оценке влияния вибрации на воспалительные процессы верхних дыхательных путей было in-vivo. Было установлено вибрации-индуцированное увеличение провоспалительных цитокинов, фактора некроза опухоли-альфа, нейтрофилов в мягких тканях неба. Был сделан вывод, что механическое воздействие вибрации (60 Гц) является триггером раннего провоспалительного процесса в бронхиальных эпителиальных клетках [39,40].
В других экспериментальных исследованиях было установлено, что храп ассоциируется с трансмиссией энергии вибрации в ткани окружающих сонную артерию и ее стенки. Высказано предположение, что вибрация при храпе является потенциальным источником энергии, ведущей к повреждению сосудистой стенки сонной артерии и/или разрыву атеросклеротической бляшки [41,42]. В 2011 году Cho Jin-G. с соавт. провели первое экспериментальное исследование, в котором показали, что вибрация вызывает эндотелиальную дисфункцию в каротидных артериях, что и может объяснять развитие каротидного атеросклероза у лиц с храпом. С тех пор гипотеза, что храп является потенциальным фактором повреждения артериальной стенки и прогрессирования атеросклероза каротидных артерий продолжает активно изучаться [44,45,46].
В связи с этими данными прослеживается аналогия и возникает вопрос, могут ли свистящие хрипы влиять на сосудистое звено нижних дыхательных путей. Тем более, что в последние годы накапливается все больше данных об изменениях микроциркуляторного русла и ремоделирование сосудов дыхательных путей у больных БА и ХОБЛ [47, 48,49,50]. Предполагают, что сосудистый компонент ремоделирования дыхательных путей участвует в механизмах развития этих заболеваний и представляет собой сложный, многоступенчатый феномен с участием различных медиаторов [51] .
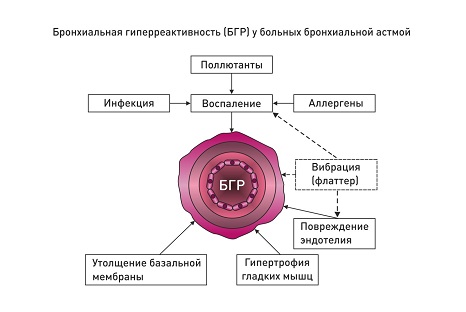
Итак, вышеприведенные данные указывают, что вибрация при храпе способствует воспалительным изменениям, нарушениям функции эндотелия в верхних отделах дыхательных путей. В связи с этими данными можно сделать предположение, что флаттер (вибрация) как ключевой механизм свистящих хрипов, и у больных БА может способствовать аналогичным изменениям: воспалительным изменениям, эндотелиальной дисфункции в микроциркуляторном русле нижних отделах дыхательных путей. (рис. 1).
Рассматривая вопросы вибрационного воздействия, следует также отметить, что создание положительного давления в дыхательных путях ( CPAP терапия) в настоящее время изучается как один из возможных методов лечения больных БА. Было показано, что 7-дневное применение CPAP терапии уменьшает гиперреактивность дыхательных путей у клинически стабильных больных БА [52]. CPAP терапию рассматривают и как механический бронходялятатор у больных БА с гипереактивностью дыхательных путей [53]. CPAP терапия может уменьшать симптомы астмы даже если пациент не имеет ночного апное [54]. Исходя из этих данных можно предположить, что СРАР терапия (создание положительного давления в дыхательных путях) влияет и на механизмы развития свистящих хрипов у больных БА, оказывая тем самым положительные эффекты.
Литература
1. Warner S.M., Knight D.A. Airway modeling and remodeling in the pathogenesis of asthma. Curr. Opin. Allergy. Clin. Immunol. 2008 Feb; 8 (1): 44-48.
2. Yamauchi K., Inoue H. Airway remodeling in asthma and irreversible airflow limitation-ECM deposition in airway and possible therapy for remodeling. Allergol. Int. 2007; 56 (4): 321-9.
3. Durrani S.R., Viswanathan R.K., Busse W.W. What effect does asthma treatment have on airway remodeling? Current perspectives. J. Allergy. Clin. Immunol. 2011; 128 (3): 439–448.
4. Keglowich L.F., Borger P. The Three A's in Asthma - Airway Smooth Muscle, Airway Remodeling & Angiogenesis. Open. Respir. Med. J. 2015; 9: 70-80.
5. Alagappan V.K., de Boer W.I., Misra V.K. Angiogenesis and Vascular Remodeling in Chronic Airway Diseases. Cell Biochemistry and Biophysics. 2013; 67 ( 2): 219-234.
6. Busse W.W. The relationship of airway hyperresponsiveness and airway inflammation: airway hyperresponsiveness in asthma: its measurement and clinical significance. Chest. 2010;138(2): 4–10.
7. Sistek D., Wickens K., Amstrong R., D'Souza W., Town I., Crane J. The Respir. Med. 2006; 100 (12): 2107-11. Predictive value of respiratory symptoms and bronchial hyperresponsiveness to diagnose asthma in New Zealand.
8. Ishizuka T., Matsuzaki Sh., Aoki H. Prevalence of asthma symptoms based on the European Community Respiratory Health Survey questionnaire and FE NO in university students: gender differences in symptoms and FE NO. Allergy, Asthma & Clinical Immunology. 2011; 7: 15.
9. Чучалин А.Г., Айсанов З.Р., Белевский А.С. и др. Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы. Пульмонология. 2014.
10. Variations in the prevalence of respiratory symptoms, self-reported asthma attacks, and use of asthma medication in the European Community Respiratory Health Survey (ECRHS). Eur. Respi.r J. 1996;9(4):687–695.
11. Sistek D., Tschopp J.M., Schindler C., Brutsche M., Ackermann-Liebrich U., Perruchoud A.P., Leuenberger P. Clinical diagnosis of current asthma: predictive value of respiratory symptoms in the SAPALDIA study. Swiss Study on Air Pollution and Lung Diseases in Adults. Eur. Respir. J. 2001; 17 (2): 214–219.
12. Walker H.K., Hall W.D., Hurst J.W. Clinical Methods: The History, Physical and Laboratory Examinations. 3rd.ed. Wheezing and Asthma. Henry Gong, J.R. Chapter 37, Boston: Butterworths; 1990.
13. Busse W.W. What is the best pulmonary diagnostic approach for wheezing patients with normal spirometry? Respir. Care. 2012; 57 (1): 39-46.
14. Global Strategy for Asthma Management and Prevention (GINA). Updated 2015.
15. Nagasaka Y., Tsuchiya M., Sakaguchi C. Breath. Sounds as Biomarker of Bronchial Asthma. PROCEEDINGS of the 40th International Lung Sounds Association Conference 24th – 25th September 2015.St. Petersburg, Russia.
16. Huang W.C., Tsai Y.H., Wei Y.F. Wheezing, a significant clinical phenotype of COPD: experience from the Taiwan Obstructive Lung Disease Study. Int .J. Chron. Obstruct. Pulmon. Dis. 2015; 10: 2121-2126.
17. American Thoracic Society Ad Hoc Committee on Pulmonary Nomenclature. Updated nomenclature for membership reaction. ATS News. 1977; 3: 5–6.
18. Reichert S., Gass R., Brandt C., Andres E. Analysis of respiratory sounds: state of the art. Clin. Med. Circ. Respir. Pulm. Med. 2008; 2: 45-58.
19. Pasterkamp H., Brand P.L.P., Everard M. Towards the standardisation of lung sound nomenclature. Eur. Resp.J. 2016; 47 (3): 724-732.
20. Fiz J.A., Jane R., Izquierdo J. Analysis of forced wheezes in asthma patients. Respi. 2006; 73 (1): 55-60.
21. Коренбаум В.И., Почекутова И.А. Акустико-биомеханические взаимосвязи в формировании шумов выдоха человека. Владивосток. Дальнаука. 2006. С. 142.
22. Oliveira A., Marques A. Respiratory sounds in healthy people: a systematic review. Respir. Med. 2014; 108 (4): 550-70.
23. Guntupalli K.K., Alapat P.M., Bandi V.D., Kushnir I. Validation of automatic wheeze detection in patients with obstructed airways and in healthy subjects. J. Asthma. 2008; 45 (10): 903-7.
24. Marques A., Oliveira A., Jacome C. Computerized adventitious respiratory sounds as outcome measures for respirator y therapy: a systematic review. Respir. Care. 2014; 59 (5): 765-76.
25. Петров Ю.В., Глотов С.И., Абросимов В.Н. Первый опыт применения интрапульмональной электронной аускультации у пациентов с хронической обструктивной болезнью легких и бронхиальной астмой. Наука молодых (Eruditio Jevenium). Рязань. 2015;4: 45-49.
26. Wilkins R.L., Dexter J.R., Smith J.R. Survey of adventitious lung sound terminology in case reports. Chest. 1984; 85 (4): 523-5.
27. Gurung A., Scrafford C.G., Tielsch J.M. Computerized lung sound analysis as diagnostic aid for the detection of abnormal lung sounds: a systematic review and meta-analysis. Respir. Med. 2011; 105 (9): 1396-403.
28. Nagasaka Y. Lung sounds in bronchial asthma. Allergol. Int. 2012; 61 (3): 353- 63.
29. Sarkar M., Madabhavi I., Niranjan N., Dogra M. Auscultation of the respiratory system. Ann. Thorac. Med. 2015; 10 (3): 158–168.
30. Коренбаум В.И., Рассказова М.А., Почекутова И.А., Фершалов Ю.А. Механизмы шумообразования свистящих хрипов, наблюдаемых при форсированном выдохе здорового человека. Акустический журнал. 2009; 55 (4-5): 516-525.
31. Дьяченко А.И., Михайловская А.Н. Респираторная акустика (обзор). Лазерная и акустическая биомедицинская диагностика. М.: Наука, 2012. (труды ИОФАН; т.68): 156-170.
32. Gavriely N., Palti Y., Alroy G., Grotberg J.B. Measurement and theory of wheezing breath sound. J. App. Physiol. 1984; 57: 481-92.
33. Mehta A.C., Gat M., Mann S., Madison J.M. Accuracy of gray-scale coding in lung sound mapping. Comput. Med. Imaging. Graph. 2010; 34(5): 362-9.
34. Guntupalli K.K., Reddy R.M., Loutfi R.H., Alapat P.M., Bandi V.D., Hanania NA. Evaluation of obstructive lung disease with vibration response imaging. J. Asthma. 2008; 45 (10): 923-30.
35. Berry M.P., Camporota L., and Ntoumenopoulos G. Vibration response imaging: protocol for a systematic review. Syst. Rev. 2013; 2: 86.
36. Dellinger R.P., Parrillo J.E., Kushnir A., Rossi M., Kushnir I. Dynamic visualization of lung sounds with a vibration response device: a case series. Respir. 2008; 75 (1): 60-72.
37. Dai Z., Peng Y., Mansy H.A., Sandler R.H., Royston T.J. Experimental and Computational Studies of Sound Transmission in a Branching Airway Network Embedded in a Compliant Viscoelastic Medium. J. Sound. Vib. 2015; 339: 215-229.
38. Puig F., Rico F., Almendros I. Vibration enhances interleukin-8 release in a cell model of snoring-induced airway inflammation. Sleep. 2005; 28 (10): 1312-6.
39. Almendros I., Acerbi I., Puig F. Upper-airway inflammation triggered by vibration in a rat model of snoring. Sleep. 2007; 30 (2): 225-7.
40. Almendros I., Carreras A., Ramirez J. Upper airway collapse and reopening induce inflammation in a sleep apnoea model. ERJ. 2008; 32 (2): 399-404.
41. Amatoury J., Howitt L., Wheatley J.R. Snoring-related energy transmission to the carotid artery in rabbits. J. Appl. Physiol. 2006; 100 (5): 1547-53.
42. Howitt L., Kairaitis K., Kirkness J.P. Oscillatory pressure wave transmission from the upper airway to the carotid artery. J. Appl. Physiol. Publ. 2007; 103 (5): 1622-1627
43. Cho J.G., Witting P.K., Verma M. Tissue vibration induces carotid artery endothelial dysfunction: a mechanism linking snoring and carotid atherosclerosis? Sleep. 2011; 34 (6): 751-757.
44. Lee S., Amis T., Byth K. Heavy snoring as a cause of carotid artery atherosclerosis. Sleep . 2008; 31: 1207–13.
45. Deeb R., Judge P., Peterson E., Lin J.C., Yaremchuk K. Laryngoscope. Snoring and carotid artery intima-media thickness. 2014;124 (6): 1486-91.
46. Damiani M.F., Zito A., Carratu P., Falcone V.A., Bega E., Scicchitano P., Ciccone M.M., Resta O. Obstructive Sleep Apnea, Hypertension and Their Additive Effects on Atherosclerosis. Biochem. Res. Int. 2015; 2015: 984193.
47. Alagappan V.K., de Boer W.I., Misra V.K. Angiogenesis and Vascular Remodeling in Chronic Airway Diseases. Cell Biochemistry and Biophysics. 2013; 67 ( 2): 219-234.
48. Meyer N., Akdis C.A. Vascular endothelial growth factor as a key inducer of angiogenesis in the asthmatic airways. Curr. Allergy. Asthma. Rep. 2013;13(1):1-9.
49. Olivieri D., Chetta A. Therapeutic perspectives in vascular remodeling in asthma and chronic obstructive pulmonary disease. Chem. Immunol. Allergy. 2014; 99: 216-25.
50. Bakakos P., Patentalakis G., Papi A. Vascular Biomarkers in Asthma and COPD. Curr. Top. Med. Chem. 2016; 16 (14): 1599-609..
51. Zanini F., Cherubino F., Pignatti P., Spanevello A. Angiogenesis and bronchial vascular remodeling in asthma and COPD. Shortness of Breath. 2013; 2(4): 1151-156.
52. Busk M., Busk N., Puntenney P. Use of continuous positive airway pressure reduces airway reactivity in adults with asthma. Eur. Respir. J. 2013; 41 (2): 317-22.
53. Esoquinas A.M., Ozyilmaz E. Mechanical bronchodilatation for asthmatic airway: role of CPAP therapy Tuberk Toraks. 2013; 61 (3): 263-264.
54. D'Amato M., Stanziola A.A., de Laurentiis G. Nocturnal continuous positive airway pressure in severe non apneic asthma. A pilot study. Clin. Respir. J. 2014; 8 (4): 417-24.